অক্সাইড

অক্সাইড (টেমপ্লেট:Lang-en টেমপ্লেট:IPAc-en) হলো এক প্রকারের রাসায়নিক যৌগ যেখানে অক্সিজেন ও অপর কোন মৌলের, উভয়ের অন্তত একটি করে পরমাণু থাকে।[১] "অক্সাইড" নিজেই অক্সিজেনের ডাই-অ্যানায়ন (অ্যাানায়ন যার নেট চার্জ -২), এটি হলো O2– আয়ন যেখানে অক্সিজেনের জারণ অবস্থা -২। অধিকাংশ ভূ-ত্বকই মূলত অক্সাইড দ্বারা গঠিত। এমনকি মৌলিক পদার্থের উপাদান হিসাবে বিবেচিত উপকরণগুলোও প্রায়শই একটি অক্সাইডের আবরণ তৈরি করে। উদাহরণস্বরূপ, অ্যালুমিনিয়াম ফয়েলের উপর পাতলা অ্যালুমিনিয়াম অক্সাইডের এর আস্তরণ থাকে যা ফয়েলটিকে অধিকতর জারণ থেকে রক্ষা করে।[২]
স্টয়কিওমেট্রি (রাসায়নিক বিক্রিয়ার সমীকরণ বা বিক্রিয়ার, বিক্রিয়ক এবং রাসায়নিক সমীকরণের মধ্যকার পরিমাপযোগ্য সম্পর্ক)
স্টয়কিওমেট্রির পরিপ্রেক্ষিতে এবং প্রতিটি স্টয়কিওমেট্রির কাঠামোর ক্ষেত্রে অক্সাইডগুলি অসাধারণভাবে বৈচিত্র্যময়। বেশিরভাগ উপাদানই একাধিক স্টোইচিওমেট্রির অক্সাইড গঠন করে। এটার একটি সুপরিচিত উদাহরণ হল, কার্বন মনোক্সাইড এবং কার্বন ডাই অক্সাইড। [২] এটি শুধু বাইনারী অক্সাইডের ক্ষেত্রেই প্রযোজ্য, অর্থাৎ, যেসব যৌগ শুধুমাত্র অক্সাইড এবং অন্য একটি উপাদান দিয়ে গঠিত। বাইনারি অক্সাইডের চেয়েও অনেক সহজলভ্য হলো আরও জটিল স্টোইচিওমেট্রির অক্সাইড। এসব জটিলতা অন্য ক্যাটায়ন (একটি ধনাত্মক চার্জযুক্ত আয়ন, অর্থাৎ যা ইলেক্ট্রোলাইসিসে ক্যাথোডের প্রতি আকৃষ্ট হয়) বা অন্য অ্যানায়ন (একটি ঋণাত্মক চার্জযুক্ত আয়ন) এর জন্য তৈরি হতে পারে। আয়রন সিলিকেট, Fe2SiO4, খনিজ ফায়ালাইট, যা টারনারি অক্সাইডের বহু উদাহরণের মধ্যে একটি। অনেক ধাতব অক্সাইডের জন্য, পলিমারফিজম এবং ননস্টোইচিওমেট্রি থাকার সম্ভাবনাও বিদ্যমান।[৩] উদাহরণস্বরূপ, টাইটানিয়ামের বাণিজ্যিকভাবে গুরুত্বপূর্ণ ডাই অক্সাইডগুলো তিনটি স্বতন্ত্র কাঠামোতে বিদ্যমান। অনেক ধাতব অক্সাইড বিভিন্ন ননস্টোইচিওমেট্রিক অবস্থায় বিদ্যমান। বহু আণবিক অক্সাইডসমূহ বিভিন্ন লিগ্যান্ডের সাথেও থাকে।[৪]
সরলতার জন্য, এই নিবন্ধের বেশিরভাগেই বাইনারি অক্সাইডের উপর গুরুত্ব দেয়া হয়েছে।
সৃজন/উৎপাদন
অক্সাইড কয়েকটি অভিজাত গ্যাস ছাড়া সমস্ত উপাদানের সাথে যুক্ত হয়। এইসব বৈচিত্র্যময় ধরনের যৌগগুলো গঠনের পথসমূহও অনুরূপভাবে অসংখ্য।
ধাতব অক্সাইড
অনেক ধাতব অক্সাইড অন্যান্য ধাতব যৌগের বিয়োজন থেকে উদ্ভূত হয়, যেমন কার্বনেট, হাইড্রক্সাইড এবং নাইট্রেট। ক্যালসিয়াম অক্সাইড তৈরির সময়, ক্যালসিয়াম কার্বনেট (চুনাপাথর) উত্তপ্ত হয়ে ভেঙ্গে গিয়ে কার্বন ডাই অক্সাইড নির্গত করে।[২]
বাতাসের অক্সিজেনের সাথে উপাদানসমূহের বিক্রিয়াই হলো ক্ষয়ের মূল কারণ, বিশেষত লোহার বাণিজ্যিক ব্যবহারের ক্ষেত্রে। প্রায় সব উপাদানই অক্সিজেনসমৃদ্ধ পারিপার্শ্বিক অবস্থায় উত্তপ্ত করলে অক্সাইড তৈরি করে। উদাহরণস্বরূপ, জিঙ্ক অক্সাইড তৈরিতে জিঙ্ক পাউডার বাতাসে জ্বলবে:[৫]
আকরিক থেকে ধাতু উৎপাদনে প্রায়ই বাতাসে ধাতব সালফাইড খনিজ দগ্ধ (উতপ্ত) করে অক্সাইড উৎপাদন জড়িত। এইভাবে, (মলিবডেনাইট) মলিবডেনাম ট্রাইঅক্সাইডে রূপান্তরিত হয়, যা কার্যত সমস্ত মলিবডেনাম যৌগের পূর্বসূরী:[৬]
অভিজাত ধাতুসমূহ (যেমন সোনা এবং প্ল্যাটিনাম) মূল্যবান কারণ তারা অক্সিজেনের সাথে সরাসরি রাসায়নিক সংমিশ্রণকে প্রতিরোধ করে।[২]
অ-ধাতু অক্সাইড
গুরুত্বপূর্ণ এবং প্রভাবশালী অধাতব অক্সাইডগুলো হলো কার্বন ডাই অক্সাইড এবং কার্বন মনোক্সাইড। এই উৎপাদগুলি কার্বন বা হাইড্রোকার্বনের সম্পূর্ণ বা আংশিক জারণের ফলে তৈরি হয়।[২]
অতিরিক্ত অক্সিজেনের সাথে বিক্রিয়ায় ডাই অক্সাইড হলো উৎপাদ, কার্বন মনোক্সাইডের মধ্যস্থতায় এই বিক্রিয়ার পথ এগিয়ে যায়:
মৌলিক নাইট্রোজেন () অক্সাইডে রূপান্তর করা কঠিন, কিন্তু অ্যামোনিয়ার দহন নাইট্রিক অক্সাইড প্রদান করে, যা অক্সিজেনের সাথে আরও বিক্রিয়া করে:
নাইট্রিক অ্যাসিড উত্তপাদনে এই বিক্রিয়াগুলি চর্চা করা হয়, যা একটি রাসায়নিক পণ্য।[৭]
শিল্পে সবচেয়ে বেশি পরিমানে উৎপাদিত রাসায়নিক হলো সালফিউরিক অ্যাসিড। এটি প্রস্তুত হয় সালফার এর জারণে সালফার ডাই অক্সাইড উত্তপন্নের মাধ্যমে, যাকে আবার পরবর্তীতে আলাদাভাবে জারিত করে সালফার ট্রাইঅক্সাইডে পরিণত করা হয়।[৮]
অবশেষে ট্রাইঅক্সাইড একটি হাইড্রেশন বিক্রিয়া দ্বারা সালফিউরিক অ্যাসিডে রূপান্তরিত হয়:
গঠন
স্বতন্ত্র অণু থেকে শুরু করে পলিমারিক এবং স্ফটিক কাঠামো পর্যন্ত, অক্সাইডগুলোর বিভিন্ন রকম কাঠামো রয়েছে। আদর্শ অবস্থায়, অক্সাইডগুলি কঠিন থেকে গ্যাস পর্যন্ত হতে পারে।ধাতুর কঠিন অক্সাইডগুলোর সাধারণত পরিবেষ্টিত অবস্থায় পলিমারিক কাঠামো থাকে।[৯]
আণবিক অক্সাইড
- কিছু গুরুত্বপূর্ণ গ্যাসীয় অক্সাইড
-
কার্বন ডাই অক্সাইড জীবাশ্ম জ্বালানী দহনের প্রধান উৎপাদ
-
কার্বন মনোক্সাইড হলো কার্বন-ভিত্তিক জ্বালানীর অসম্পূর্ণ দহনের উৎপাদ এবং অনেক দরকারী রাসায়নিকের অগ্রদূত
-
নাইট্রোজেন ডাই অক্সাইড অভ্যন্তরীণ দহন ইঞ্জিন থেকে উৎপন্ন একটি সমস্যাযুক্ত দূষণকারী।
-
সালফার ডাই অক্সাইড, সালফারের প্রধান অক্সাইড, আগ্নেয়গিরি থেকে নির্গত হয়।
-
নাইট্রাস অক্সাইড ("লাফিং গ্যাস") মাটির ব্যাকটেরিয়া দ্বারা উৎপাদিত একটি শক্তিশালী গ্রিনহাউস গ্যাস।
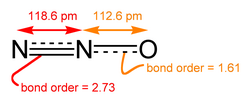
যদিও বেশিরভাগ ধাতব অক্সাইড স্ফটিক কঠিন, তবে কিছু অক্সাইড আনবিকও হয়। আণবিক অক্সাইডের উদাহরণসমূহ হলো কার্বন ডাই অক্সাইড এবং কার্বন মনোক্সাইড। নাইট্রোজেনের সকল সরল অক্সাইডগুলি আণবিক হয়, যেমন,
,
,
এবং
। ফসফরাস পেন্টোক্সাইড একটি জটিল আণবিক অক্সাইড যার নামটি বিভ্রান্তিকর, এর আসল রাসায়নিক ফরমূলা হচ্ছে
। টেট্রোক্সাইড বিরল, এর কয়েকটি সাধারণ উদাহরণ হলো রুথেনিয়াম টেট্রোক্সাইড, অসমিয়াম টেট্রোক্সাইড এবং জেনন টেট্রোক্সাইড।[২]
বিক্রিয়াসমূহ
বিয়োজন
কিছু ধাতুর উৎপাদনে ধাতুর অক্সাইডকে ধাতুতে হ্রাস করার চর্চা করা হয় বৃহৎ পরিসরে। অনেক ধাতব অক্সাইড শুধু গরম করার মাধ্যমেই ধাতুতে রূপান্তরিত হয়, (তাপীয় বিয়োজন দেখুন)। উদাহরণস্বরূপ, সিলভার অক্সাইড ২০০ ডিগ্রি সেলসিয়াসে বিয়োজিত হয়ঃ[১০]
যদিও বেশিরভাগ ক্ষেত্রে, রাসায়নিক বিকারক দ্বারা ধাতব অক্সাইড বিয়োজিত করা হয়। একটি প্রচলিত এবং সস্তা বিয়োজনকারী এজেন্ট হলো কোক(পোড়া কয়লা) আকারে কার্বন। লোহা আকরিক গলানো হলো এর সবচেয়ে বিশিষ্ট উদাহরণ। এই প্রক্রিয়ায় অনেকগুলো বিক্রিয়া জড়িত, কিন্তু প্রক্রিয়ার যে সরলীকৃত সমীকরণ সাধারণত দেখানো হয় তা হল:[২]
কিছু ধাতব অক্সাইড বিয়োজনকারী এজেন্টের উপস্থিতিতে দ্রবীভূত হয়, এগুলোর মধ্যে জৈব যৌগও অন্তর্ভুক্ত থাকতে পারে। ফেরিক অক্সাইডের বিয়োজনমূলক দ্রবীভূতকরণ ভূ-রাসায়নিক ঘটনা যেমন আয়রন চক্রের অবিচ্ছেদ্য অংশ।[১১]
হাইড্রোলাইসিস এবং দ্রবীভূতকরণ
যেহেতু বন্ধনগুলি সাধারণত শক্তিশালী হয়, ধাতব অক্সাইডগুলি দ্রাবকগুলিতে অদ্রবণীয় হতে থাকে, যদিও তারা জলীয় অ্যাসিড এবং ক্ষার দ্বারা আক্রান্ত হতে পারে।[২]
অক্সাইড দ্রবীভূত করলে প্রায়ই অক্সি-অ্যানায়ন দেয়। এ জলীয় ক্ষার যোগ করলে বিভিন্ন ধরনের ফসফেট পাওয়া যায়। এ জলীয় ক্ষার যোগ করলে পলিঅক্সোমেটালেট পাওয়া যায়। অক্সিকেশন বিরল, এর কিছু উদাহরণ হলো নাইট্রোসোনিয়াম (), ভ্যানাডিল (), এবং ইউরানাইল ()। অবশ্যই অনেক যৌগ অক্সাইড এবং অন্যান্য গ্রুপ, উভয় হিসেবেই পরিচিত হয়। জৈব রসায়নে, এইসব যৌগের মধ্যে রয়েছে কিটোন এবং বহু কার্বনাইল সম্পর্কিত যৌগ। ট্রানজিশন ধাতুগুলির ক্ষেত্রে, অনেক অক্সো কমপ্লেক্সের পরিচয় পাওয়া যায়, সেই সাথে অক্সিহালাইডও পাওয়া যায়।[২]
নামকরণ এবং রাসায়নিক সূত্র
রাসায়নিক উপাদানসমূহের অক্সাইডগুলোর রাসায়নিক ফরমূলা তাদের সর্বোচ্চ জারণ অবস্থায় অনুমানযোগ্য এবং সেই উপাদানটির যোজ্যতা ইলেকট্রনের সংখ্যা থেকে তা পাওয়া যায়। এমনকি , টেট্রাঅক্সিজেন এর রাসায়নিক ফরমূলাও, গ্রুপ 16 এর একটি উপাদান হিসাবে অনুমান করা যায়। এর একটি ব্যতিক্রম হলো তামা, যার জন্য সর্বোচ্চ জারণ অবস্থার অক্সাইড হলো কপার (II) অক্সাইড এবং মোটেই কপার(I) অক্সাইড নয়। আরেকটি ব্যতিক্রম হলো অক্সিজেন ফ্লোরাইড, যেটি অনেকে হয়ত হিসেবে আশা করতে পারে কিন্তু তার অস্তিত্বই নেই বরং এটি পাওয়া যায় হিসাবে।[১২]
আরও দেখুন
- অন্যান্য অক্সিজেন আয়নসমূহ হলো ওজোনাইড, , সুপারঅক্সাইড ,পারক্সাইড , এবং ডাইঅক্সিজেনাইল,
- সাব-অক্সাইড
- অক্সোহ্যালাইড
- অক্সি-অ্যানায়ন
- জটিল অক্সাইড
- লবণ
- জলীয় ইলেকট্রন
তথ্যসূত্র
বহিঃসংযোগ
টেমপ্লেট:কর্তৃপক্ষ নিয়ন্ত্রণ টেমপ্লেট:রসায়ন-অসম্পূর্ণ
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ ২.০ ২.১ ২.২ ২.৩ ২.৪ ২.৫ ২.৬ ২.৭ ২.৮ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:সাময়িকী উদ্ধৃতি
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:ওয়েব উদ্ধৃতি
- ↑ টেমপ্লেট:বই উদ্ধৃতি
- ↑ টেমপ্লেট:সাময়িকী উদ্ধৃতি