হাইড্রোজেনের আইসোটোপসমূহ
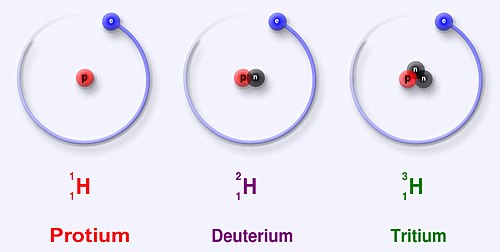
প্রোটিয়াম (A = ১), ডিউটেরিয়াম (A = ২), এবং ট্রিটিয়াম (A = ৩).
(H) ( প্রমাণ পারমাণবিক ভর: ১.০০৭৯৪ u) এর প্রাকৃতিকভাবে সংঘটিত ৩টি আইসোটোপ রয়েছে, যা মাঝে মাঝে 1H, 2H এবং 3H দ্বারা প্রকাশ করা হয়। অন্যান্যগুলো অত্যন্ত অস্থিতিশীল নিউক্লিয়াস (4H থেকে 7H), যা গবেষণাগারে কৃত্রিম উপায়ে তৈরী কিন্তু প্রকৃতিতে সংঘটিত হয় না। সবচেয়ে স্থিতিশীল রেডিওআইসোটোপ হল টিট্রিয়াম, যার অর্ধ জীবন ১২.৩২ বছর। সকল ভারী আইসোটোপই কৃত্রিম এবং এক জেপ্টোসেকেন্ডের (১০−২১ সেকেন্ডে) চেয়েও কম অর্ধ জীবন রয়েছে। যার মধ্যে 5H হল সবচেয়ে স্থিতিশীল এবং সবচেয়ে কম স্থিতিশীল আইসোটোপ হল 7H[১][২]।
হাইড্রোজেন হল একমাত্র উপাদান যার আইসোটোপসমূহ আজকাল বিভিন্ন নামে ব্যবহার করা হয়। ২H (অথবা হাইড্রোজেন-২) আইসোটোপকে সাধারণত ডিউটেরিয়াম বলা হয় এবং ৩H (অথবা হাইড্রোজেন-৩) আইসোটোপকে সাধারণত ট্রিটিয়াম বলা হয়। D এবং T অক্ষর দুটি (২H ও ৩H এর পরিবর্তে) কখনও কখনও ডিউটেরিয়াম এবং ট্রিটিয়াম এর পরিবর্তে ব্যবহার করা হয়। কিন্তু এটি পেশ করা হয় না কারণ এটি রাসায়নিক সূত্রের বর্ণানুক্রমিক শ্রেণিবিভাজনে সমস্যা সৃষ্টি করে। হাইড্রোজেনের একটি সাধারণ আইসোটোপ যার কোন নিউট্রন নেই তাকে কখনও কখনও প্রোটিয়াম বলা হয়।
হাইড্রোজেন-১ (প্রোটিয়াম)
টেমপ্লেট:বিস্তারিত 1H (আণবিক ভর ১.০০৭৮২৫০৪(৭) u) হল হাইড্রোজেনের সবচেয়ে প্রচলিত একটি আইসোটোপ যার প্রাচুর্যতা ৯৯.৯৮% এর অধিক। কারণ এই আইসোটোপের নিউক্লিয়াস শুধুমাত্র ১টি একা প্রোটন দ্বারা গঠিত।
এই প্রোটনটি কখনোই ক্ষয় হতে দেখা যায়নি এবং যদিও হাইড্রোজেন-১ কে স্থিতিশীল আইসোটোপ হিসেবেই বিবেচনা করা হয়। কণা পদার্থবিদ্যায় সাম্প্রতিক কিছু তথ্যে ধরে নেয়া হয়েছে যে প্রোটন ক্ষয় ১০৩৬ বছরের একটি অর্ধায়ুর সহিত ঘটতে পারে। যদি এই ধারণা সত্য হয় তবে হাইড্রোজেন-১ (এবং মূলত সকল নিউক্লিয়াসই এখন স্থিতিশীল বিশ্বাস করা হয়) শুধুমাত্র বিবেচনাভিত্তিক স্থিতিশীল। এখন পর্যন্ত সকল পরীক্ষায় দেখা গেছে যে যদি প্রোটন ক্ষয় ঘটে তবে এটির অর্ধায়ু ৬.৬ × ১০৩৩ বছরের বেশি হতে হবে।
হাইড্রোজেন-২ (ডিউটেরিয়াম)

2H হল হাইড্রোজেনের অন্য একটি স্থিতিশীল আইসোটোপ, যা ডিউটেরিয়াম নামে পরিচিত এবং এটির নিউক্লিয়াস একটি প্রোটন ও একটি নিউট্রন দ্বারা গঠিত। পৃথিবীতে হাইড্রোজেন নমুনার ০.০০২৬ – ০.০১৮৪% (পারমানবিক সংখ্যা দ্বারা, ভর দ্বারা নয়) হল ডিউটেরিয়াম। যার খুব কম পরিমাণই হাইড্রোজেন গ্যাসের নমুনায় পাওয়া যায় এবং বৃহত্ পরিমাণ অংশ (০.০১৫% অথবা ১৫০ ppm = "parts per million" ) সামুদ্রিক পানি ধারণ করে। পৃথিবীতে ডিউটেরিয়াম পরমাণু বিগ ব্যাং এর সময় ও সোলার সিস্টেমের বাইরে (পরমাণু ভাংগন দ্বারা প্রায় ২৭ পিপিএম) এবং আকাশগঙ্গা ছায়াপথের পুরোনো অংশে (প্রায় ২৩ পিপিএম) তার প্রাথমিক ঘনত্ব হতে নির্দিষ্ট মানে বৃদ্ধি পেয়েছে।
ডিউটেরিয়াম তেজস্ক্রিয় হয় না এবং এটি কোন উল্লেখযোগ্য বিষাক্ততার ঝুঁকি দেখায় না। সমৃদ্ধ পানির অণু স্বাভাবিক হাইড্রোজেন পরমাণুর পরিবর্তে ডিউটেরিয়াম পরমাণুর দিয়ে গঠিত যা ভারী পানি নামে পরিচিত। ডিউটেরিয়াম এবং তার যৌগেসমূহ রাসায়নিক পরীক্ষায়সমূহে একটি অ-তেজস্ক্রিয় লেবেল হিসেবে এবং 1H-এনএমআর বর্ণালিবীক্ষণ যন্ত্র এর জন্য দ্রাবক হিসেবে ব্যবহার করা হয়। ভারী পানি একটি নিউট্রন নিয়ন্ত্রক এবং পারমাণবিক চুল্লি শীতলিকারক হিসেবে ব্যবহৃত হয়। ডিউটেরিয়াম বাণিজ্যিক নিউক্লিয়ার ফিউশনের জন্য একটি সম্ভাব্য জ্বালানী।
হাইড্রোজেন-৩ (ট্রিটিয়াম)

3H ট্রিটিয়াম নামে পরিচিত এবং এটির নিউক্লিয়াসের মধ্যে একটি প্রোটন এবং দুটি নিউট্রন রয়েছে। এটি তেজস্ক্রিয়, যা ১২.৩২ বছরের অর্ধায়ুর সহিত β- ক্ষয় এর মাধ্যমে হিলিয়াম-৩ এ ক্ষয়প্রাপ্ত হয়।[৩] অল্প পরিমাণ ট্রিটিয়াম প্রাকৃতিকভাবেই ঘঠিত হয়, কারণ হল বায়ুমন্ডলীয় গ্যাসের সঙ্গে কসমিক রশ্মিসমূহের পারস্পরিক ক্রিয়া। এছাড়াও পরমাণু অস্ত্র পরীক্ষার সময় ট্রিটিয়াম মুক্ত হয়।
ট্রিটিয়াম উৎপাদনের সবচেয়ে প্রচলিত একটি পদ্ধতি হল পারমাণবিক চুল্লীর মধ্যে নিউট্রনের সঙ্গে লিথিয়াম, লিথিয়াম-6 এর একটি প্রাকৃতিক উচ্চগতিসম্পন্ন আইসোটোপ কণা বর্ষণ করার মাধ্যমে।
হাইড্রোজেন-৪
4H এর নিউক্লিয়াসে একটি প্রোটন এবং তিনটি নিউট্রন রয়েছে। এটা হাইড্রোজেন এর একটি অত্যন্ত পরিবর্তনশীল আইসোটোপ। গবেষণাগারে একটি দ্রুত চলমান ডিউটেরিয়াম নিউক্লিয়াসের সঙ্গে উচ্চগতিসম্পন্ন ট্রিটিয়াম কণা বর্ষণ করার মাধ্যমে কৃত্রিমভাবে তৈরী করা হয়েছে।[৪] এই পরীক্ষায় ট্রিটিয়াম নিউক্লিয়াস দ্রুত ধাবমান ডিউটেরিয়াম নিউক্লিয়াস থেকে একটি নিউট্রন ধারণ করে। এটির পারমাণবিক ভর হল ৪.০২৭৮১ ± ০.০০০১১।[৫] এটি নিউট্রন নির্গমন এর মাধ্যমে ক্ষয়প্রাপ্ত হয় এবং এটির (১.৩৯ ± ০.১০) × ১০−২২ সেকেন্ডের একটি অর্ধায়ু রয়েছে।[৬]
হাইড্রোজেন-৫
5H হল হাইড্রোজেন এর একটি অত্যন্ত অস্থিতিশীল আইসোটোপ। এটির নিউক্লিয়াস একটি প্রোটন এবং চারটি নিউট্রন নিয়ে গঠিত। গবেষণাগারে কৃত্রিমভাবে দ্রুত চলমান ট্রিটিয়াম নিউক্লিয়াই এর সঙ্গে উচ্চগতিসম্পন্ন ট্রিটিয়াম বর্ষণ করার মাধ্যমে তৈরী হয়।[৪][৭] এই পরীক্ষায়, একটি ট্রিটিয়াম্ নিউক্লিয়াস অপরটির থেকে দুইটি নিউট্রন ধারণ করে এবং একটি প্রোটন ও চারটি নিউট্রন এর সহিত একটি নিউক্লিয়াস হয়ে উঠে। এটি দ্বিগুণ নিউট্রন নির্গমন এর মাধ্যমে ক্ষয়প্রাপ্ত হয় এবং এটির প্রায় ৯.১ × ১০−২২ সেকেন্ডের একটি অর্ধায়ু রয়েছে।[৬]
হাইড্রোজেন-৬
6H তিনগুন নিউট্রন নির্গমনের মাধ্যমে ক্ষয়প্রাপ্ত হয় এবং এটির অর্ধায়ু ২.৯০×১০−২২ সেকেন্ড।[৬]
হাইড্রোজেন-৭
7H একটি প্রোটন এবং ছয়টি নিউট্রন নিয়ে গঠিত। এটি প্রথম হিলিয়াম-৮ পরমাণুর সঙ্গে উচ্চগতিসম্পন্ন হাইড্রোজেন কণা বর্ষণের দ্বারা, রিকেন এর আরআই বিম সায়েন্স ল্যাবরেটরিতে, রাশিয়ান, জাপানি এবং ফরাসি বিজ্ঞানীদের একটি গ্রুপ দ্বারা ২০০৩ সালে সংশ্লেষিত হয়। প্রতিক্রিয়ার ফলস্বরূপ, হিলিয়াম-৮ এর ছয়টি নিউট্রন হাইড্রোজেনের নিউক্লিয়াসে দান করা হয়। অবশিষ্ট দুইটি প্রোটন "রিকেন দূরবীক্ষণ" দ্বারা সনাক্ত করা হয়, এটি বিভিন্ন স্তরের অসংখ্য সেন্সর দ্বারা গঠিত একটি যন্ত্র ।[২] হাইড্রোজেন-৭ এর ২.৩×১০−২৩ সেকেন্ডের একটি অর্ধায়ু রয়েছে।
তালিকা
| নিউক্লাইড প্রতীক |
Z(p) | N(n) | আইসোটোপিয় ভর (u) | অর্ধায়ু | ক্ষয় প্রণালী(সমূহ)[৮] |
(সমূহ)[n ১] | নিউক্লিয়ার ঘূর্ণন |
representative আইসোটোপিয় গঠন (মোল ভাংগন)[n ২] |
প্রাকৃতিক সীমার তারতম্য (মোল ভাংগন) |
|---|---|---|---|---|---|---|---|---|---|
| ১H | ১ | ০ | টেমপ্লেট:Val | স্থিতিশীল[n ৩][n ৪] | টেমপ্লেট:Frac+ | টেমপ্লেট:Val | টেমপ্লেট:Val–টেমপ্লেট:Val | ||
| ২H[n ৫] | ১ | ১ | টেমপ্লেট:Val | স্থিতিশীল | ১+ | টেমপ্লেট:Val | টেমপ্লেট:Val–টেমপ্লেট:Val | ||
| ৩H[n ৬] | ১ | ২ | টেমপ্লেট:Val | টেমপ্লেট:Val | β− | টেমপ্লেট:SimpleNuclide | টেমপ্লেট:Frac+ | ট্রেস[n ৭] | |
| টেমপ্লেট:SimpleNuclide | ১ | ৩ | টেমপ্লেট:Val | টেমপ্লেট:Val [[[:টেমপ্লেট:Val]]] |
n | টেমপ্লেট:SimpleNuclide | ২− | ||
| টেমপ্লেট:SimpleNuclide | ১ | ৪ | টেমপ্লেট:Val | >টেমপ্লেট:Val ? | 2n | টেমপ্লেট:SimpleNuclide | (টেমপ্লেট:Frac+) | ||
| টেমপ্লেট:SimpleNuclide | ১ | ৫ | টেমপ্লেট:Val | টেমপ্লেট:Val [[[:টেমপ্লেট:Val]]] |
3n | টেমপ্লেট:SimpleNuclide | ২−# | ||
| 4n | টেমপ্লেট:SimpleNuclide | ||||||||
| টেমপ্লেট:SimpleNuclide | ১ | ৬ | টেমপ্লেট:Val# | টেমপ্লেট:Val# | 4n | টেমপ্লেট:SimpleNuclide | টেমপ্লেট:Frac+# | ||
- ↑ স্থিতিশীল আইসোটোপের জন্য গাঢ়
- ↑ জলের মধ্যে নির্দেশ করে এমন।
- ↑ টেমপ্লেট:Val এর চেয়ে বৃহত্তর। দেখুন প্রোটন ক্ষয়।
- ↑ এটি এবং ৩He হল একমাত্র স্থায়ী নিউক্লাইডসমূহ যাদের নিউট্রনের চেয়ে বেশি প্রোটন রয়েছে
- ↑ মহা বিস্ফোরণ নিউক্লিওসংশ্লেষণ এর সময় উৎপাদিত
- ↑ মহা বিস্ফোরণ নিউক্লিওসংশ্লেষণ এর সময় উৎপাদিত, কিন্তু আদিম না।
- ↑ কসমোজেনিক
টীকা
- Commercially available materials may have been subjected to an undisclosed or inadvertent isotopic fractionation. Substantial deviations from the given mass and composition can occur.
- Values marked # are not purely derived from experimental data, but at least partly from systematic trends. Spins with weak assignment arguments are enclosed in parentheses.
- Uncertainties are given in concise form in parentheses after the corresponding last digits. Uncertainty values denote one standard deviation, except isotopic composition and standard atomic mass from IUPAC which use expanded uncertainties.
- Nuclide masses are given by IUPAP Commission on Symbols, Units, Nomenclature, Atomic Masses and Fundamental Constants (SUNAMCO)
- Isotope abundances are given by IUPAC Commission on Isotopic Abundances and Atomic Weights
ক্ষয় শৃঙ্খলাসমূহ
অধিকাংশ ভারী হাইড্রোজেন আইসোটোপসমূহ সরাসরি 3H তে ক্ষয়প্রাপ্ত হয়, তারপর আবার ক্ষয় হয়ে স্থিতিশীল আইসোটোপ ৩He তে পরিণত হয়। তবে, নিরীক্ষিত করা হয়েছে যে 6H মাঝে মাঝে স্থিতিশীল 2H এ সরাসরি ক্ষয়প্রাপ্ত হয়।
অতিরিক্ত চিত্র
-
একটি হাইড্রোজেন-১ পরমাণুর ত্রিমাত্রিক পরিকল্পনা (প্রোটিয়াম)
-
একটি হাইড্রোজেন-২ পরমাণুর ত্রিমাত্রিক পরিকল্পনা (ডিউটেরিয়াম)
-
একটি হাইড্রোজেন-৩ পরমাণুর ত্রিমাত্রিক পরিকল্পনা (ট্রিটিয়াম)
-
হাইড্রোজেন আইসোটোপসমূহের ত্রিমাত্রিক পরিকল্পনা
আরও দেখুন
তথ্যসূত্র
- বিশেষ দ্রষ্টব্য
- সাধারণ তথ্যসূত্র
- Isotope masses from:
- Isotopic compositions and standard atomic masses from:
- Half-life, spin, and isomer data selected from the following sources. See editing notes on this article's talk page.



